WASHINGTON — Las autoridades reguladoras de Estados Unidos autorizaron el martes el uso de emergencia de la primera prueba rápida de coronavirus que puede hacerse por entero en casa y ofrece resultados en 30 minutos.
El anuncio de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) era un gran paso en los esfuerzos de Estados Unidos por ampliar las opciones de pruebas diagnósticas de COVID-19 más allá de los centros de salud y puntos de pruebas. Sin embargo, la prueba requerirá prescripción médica, lo que probablemente limitará su uso inicial.
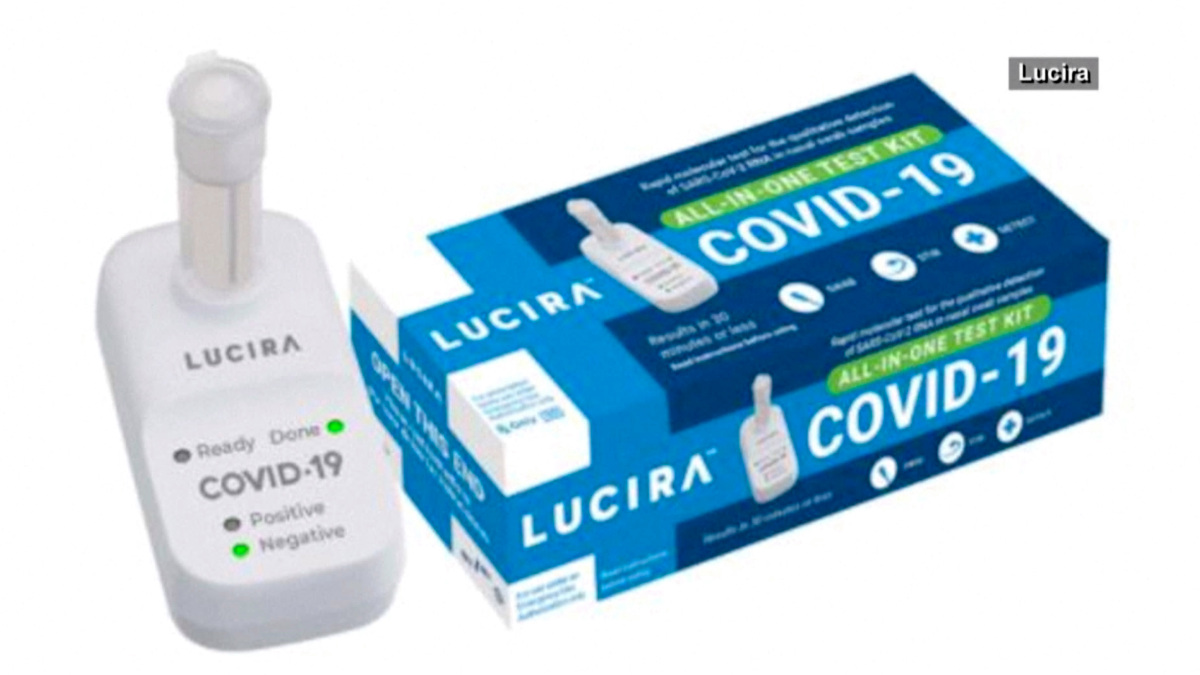
La FDA concedió la autorización de emergencia del kit de un sólo uso de Lucira Health, una fabricante de California.
La prueba de la compañía permite a los usuarios tomarse ellos mismos una muestra nasal. Después se frota el hisopo nasal en un vial con una solución de laboratorio que se conecta a un dispositivo portátil. Los resultados se muestran como luces de colores identificadas como positiva o negativa.
Hasta ahora, la FDA ha autorizado casi 300 pruebas diagnósticas de coronavirus. La gran mayoría requiere que un profesional sanitario tome las muestras en la nariz y deben procesarse en laboratorios utilizando equipo de alta tecnología. Algunas permiten que la gente tome las muestras en casa -ya sea con un hisopo nasal o una muestra de saliva- que después se envía a un laboratorio, y suele requerir una espera de varios días para conocer los resultados.
Los expertos en salud han pedido opciones que permitan a la gente hacerse la prueba en casa, reduciendo los tiempos de espera y el posible contagio del virus a otras personas, como trabajadores sanitarios.
La empresa lanzó su farmacia que permite solicitar el envío de tu receta médica, incluyendo varios fármacos de uso generalizado y hasta insulina.
Las pruebas rápidas son cruciales para poner en cuarentena con rapidez a los infectados y rastrear sus contactos. Pero durante meses, los diagnósticos en EEUU se han visto marcados por resultados lentos debido a la capacidad de los laboratorios. Hay otras pruebas rápidas, pero la mayoría requieren una pequeña máquina especial manejada por un profesional para obtener los resultados.
“Ahora, más estadounidenses que podrían tener COVID-19 podrán tomar medidas de inmediato, basándose en sus resultados, para protegerse a sí mismos y a su entorno”, dijo en un comunicado el doctor Jeff Shuren, director del centro de dispositivos de la FDA.
Lucira no respondió en un primer momento a una petición de detalles adicionales, enviada tras el final de su horario laboral el martes.
Los avances en su producción pronostican una pronta distribución.
El sistema de Lucira se desarrolló a partir de las investigaciones de la empresa para un test casero de gripe, según el sitio web de la compañía. Lucira adaptó su tecnología para detectar el COVID-19 tras el brote.
El test utiliza una tecnología similar a las pruebas de laboratorio basadas en información genética que son la herramienta estándar para detectar el nuevo coronavirus. En cambio, la mayoría de las pruebas rápidas que se utilizan ahora en EEUU buscan proteínas virales llamadas antígenos, y no al virus en sí.
Cualquiera que dé positivo debe aislarse y buscar atención médica, indicó la FDA en su nota de prensa. Las personas que den negativo pero sigan teniendo síntomas de coronavirus deben consultar a un médico, ya que un resultado negativo no descarta una infección de COVID-19.
Las autoridades de salud advierten que un resultado negativo en la prueba del COVID-19 no siginifica que puede reunir a reuniones sociales o familiares.
El sistema también se autorizó para consultas médicas y centros de pruebas. Todos los puntos de pruebas en Estados Unidos deben reportar sus resultados a autoridades estatales y federales para seguir la pista de la pandemia. Los médicos tendrán obligación de reportar los resultados de las pruebas en casa.
La FDA autorizó la nueva prueba diagnóstica empleando sus poderes de emergencia para acelerar la disponibilidad de productos experimentales durante crisis de salud pública. En circunstancias normales, la agencia requiere pruebas de seguridad y efectividad antes de dar luz verde a un nuevo test. Pero esas exigencias pueden rebajarse durante emergencias de salud pública.
La FDA no publicó la fiabilidad de la prueba ni los resultados del estudio empleado por los reguladores para tomar la decisión.
Lo que indica que las estrictas medidas de higiene, escaneo y de prevención en general implementadas por la OMS no fueron suficiente para frenar la propagación del virus.
Declaración del secretario del HHS, Alex Azar, sobre la autorización de la FDA de la primera prueba de COVID-19 para autoevaluaciones en el hogar
El martes, la Administración de Alimentos y Medicamentos (FDA) emitió una autorización de uso de emergencia (EUA) para la primera prueba de diagnóstico de COVID-19 en el hogar, el kit de prueba Lucira COVID-19 All-In-One, una prueba molecular que proporciona resultados en 30 minutos o menos y está autorizado para su uso solo con receta médica. El secretario de HHS, Alex Azar, emitió la siguiente declaración:
“Hacer posible que los estadounidenses realicen su propia autoprueba rápida de COVID-19 en casa con receta es la última incorporación a nuestro arsenal en constante expansión de opciones de prueba de COVID-19. La Administración Trump ha construido el sistema de pruebas más grande del mundo y continuaremos apoyando tanto el desarrollo como la fabricación de opciones de vanguardia para hacer que las pruebas de COVID-19 sean aún más fáciles y accesibles para el pueblo estadounidense “.
Source link